Lo hizo mediante la Resolución Nº 0007/22 donde se acopla a la Resolución N° 28 emitida en fecha 10/01/2022 por el Ministerio de Salud de la Nación
El Ministerio de Salud de Santa Fe informó que mediante la Resolución Nº 0007/22 adhiere a la Resolución N° 28 emitida en fecha 10/01/2022 por el Ministerio de Salud de la Nación, sobre el procedimiento para el reporte del uso y la notificación del resultado de los test individuales de autoevaluación para la detección del Covid-19.
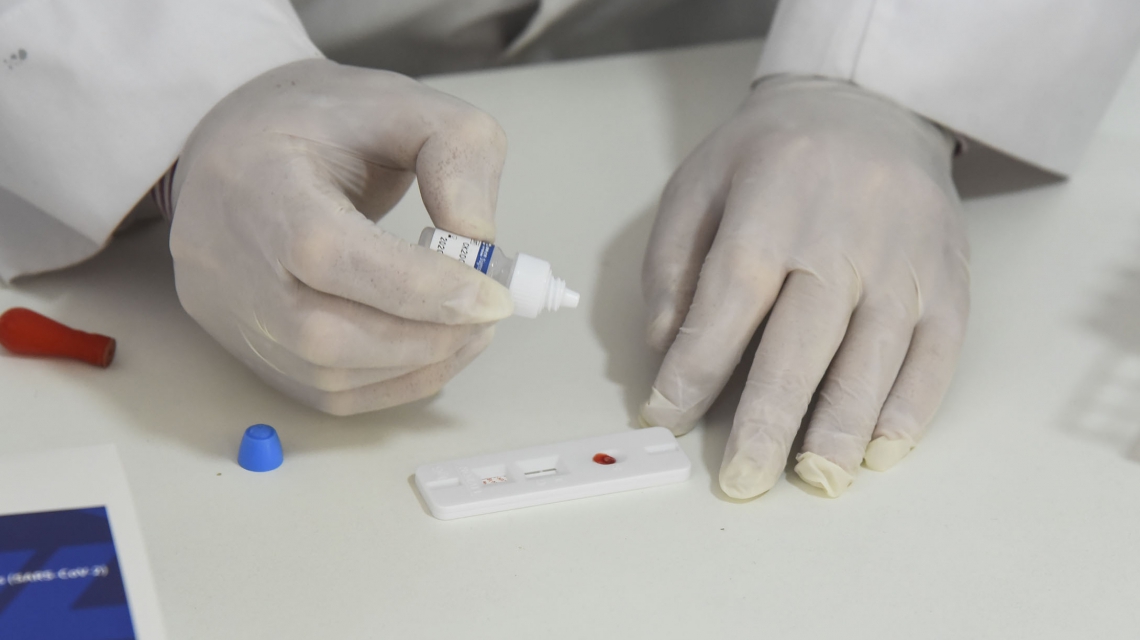
Cabe recordar que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat), autorizó el uso de las denominadas pruebas rápidas de antígeno para la detección del Coronavirus o test inmunocromatográficos para antígenos de SARS-CoV-2 para uso profesional y los diseñados para autoevaluación.
Asimismo, aprobó el uso individual de test de autoevaluación en base a la detección del virus SARS-CoV-2 de venta exclusiva en farmacias, recordando que los productos aprobados son de orientación diagnóstica y los usuarios deben recoger la muestra por sí mismos en base a las instrucciones de los fabricantes.
En este sentido, desde la cartera sanitaria destacaron que el acceso al diagnóstico oportuno es un factor determinante para disminuir la probabilidad de contagio, mejorar las medidas de aislamiento de casos positivos y el rastreo de contactos estrechos, y por consiguiente, un pilar fundamental de las medidas de contención ante una pandemia.
Del mismo modo, recordaron que esta herramienta fue implementada como test de autoevaluación desde el año pasado en países como Portugal, Francia, Países Bajos, Bélgica, Reino Unido, Italia, Alemania, España, Austria, Bulgaria y Estados Unidos.
Notificación y reporte de resultados del usuario
Ante la aprobación de los denominados autotest, se resolvió un procedimiento para hacer el correcto reporte y notificación de los resultados que arrojen los test de autoevaluación para la detección de SARS-CoV-2.
Para el adecuado reporte de resultados, los resultados del test deben ser reportados de forma individualizada (atento al código de barra de cada empaque) una vez abierto dentro de las 24 hs. de realizado el mismo, y dentro de los 7 días de adquiridos cuando no hubieran sido utilizados, ya sea por el usuario individual o por un responsable de reporte.
En el caso de que el producto sea adquirido por un usuario en una farmacia adherida, el reporte de uso siempre se hace al mismo establecimiento donde lo adquirió, para lo cual el usuario dispondrá de los siguientes canales alternativos: directamente en el punto de venta (farmacia) de forma presencial o telefónica, una página web y otros que puedan desarrollarse.
Por otra parte, si es comprado y/o utilizado por institución pública o privada, deberán designar una referente de la salud responsable del reporte de uso, e informar el destino y los resultados al lugar de adquisición o en su defecto a las autoridades sanitarias de su jurisdicción.
Finalmente, los usuarios serán responsables de reportar los resultados a la farmacia que realizó la dispensa a través de alguno de los canales habilitados para ello.
Notificación de resultados de las farmacias
Las farmacias notificarán los resultados de los test dispensados al Sistema Nacional de Vigilancia de la Salud (SNVS) a través de los usuarios habilitados, para lo cual se otorgarán los accesos al Sistema Integrado de Información Sanitaria Argentino (SISA) pertinentes.
Las instituciones públicas o privadas que adquieran o utilicen el test de autoevaluación para la detección del covid-19, notificarán los resultados al SNVS a través de los usuarios habilitados, o en su defecto cuando el reporte de uso fuera realizado ante las autoridades sanitarias de su jurisdicción, éstas deberán notificar los resultados al Sistema Nacional de Vigilancia de la Salud.
Por último, los farmacéuticos serán responsables del registro de los test dispensados, sus resultados y la identificación de usuarios en el sistema de información de las farmacias. Las agrupaciones farmacéuticas serán responsables de la notificación al SNVS.
¿Cómo se clasificarán los casos?
Los casos positivos serán integrados a la notificación de casos de COVID-19 en el SNVS y se clasificarán como casos probables, los negativos serán clasificados como «negativo, sin clasificar». Además, los casos de test inválido deberán repetirse para definir el resultado.
Un caso clasificado como «probable» deberá cumplimentar con las recomendaciones emitidas por la autoridad sanitaria de la jurisdicción vigentes al momento de realizar el test.
Aumento exponencial de casos
Desde la cartera sanitaria destacaron que dada la velocidad en el agravamiento de la situación epidemiológica a escala internacional se adoptan este tipo de medidas novedosas para hacer frente a la emergencia, para que, oportunamente, se adopten decisiones rápidas, eficaces y urgentes.
Asimismo, recordaron que en las últimas semanas se registró un aumento exponencial tanto en los contagios de las diferentes variantes del SARS-CoV-2 como en la positividad, siendo consecuencia de ello que los centros de testeos trabajen al límite de sus posibilidades en las principales ciudades del territorio provincial, por lo que resulta de vital importancia la adopción de medidas excepcionales, conforme la normativa y/o recomendaciones establecidas por el Ministerio de Salud de la Nación y la ANMAT.