En septiembre el laboratorio anunció que lanzaba el ensayo clínico fase 3 que se lleva a cabo simultáneamente en países como Argentina, Brasil y Francia, entre otros
El laboratorio MSD/Merck, Sharp & Dohme anunció este miércoles un acuerdo que podría permitir difundir en los países pobres versiones genéricas de su tratamiento anticovid-19 destinado a personas contagiadas con la enfermedad.
El Medicines Patent Pool (MPP, que negocia las licencias de tratamientos con los titulares de la patente) dijo haber firmado un acuerdo de licencia voluntaria con MSD para facilitar el acceso mundial a un precio abordable del molnupiravir, el medicamento antiviral oral experimental contra el coronavirus desarrollado por este laboratorio.
Bajo reserva de la aprobación por parte de los reguladores, el acuerdo contribuirá a dar un amplio acceso al molnupiravir en 105 países de ingresos bajos o medios.
Los reguladores de medicamentos de Estados Unidos y la Unión Europea ya están evaluando el tratamiento, según reportó la agencia AFP.
Los antivirales como el molnupiravir actúan reduciendo la capacidad de un virus a multiplicarse, frenando así la enfermedad.
El tratamiento de molnupiravir, administrado a los pacientes a los pocos días de dar positivo, reduce a la mitad el riesgo de hospitalización y muerte, según un ensayo clínico realizado por MSD.
En el marco del pacto, MSD acordó una licencia a MPP, que puede dar luego sublicencias a los fabricantes de medicamentos genéricos.
El acuerdo significa que los laboratorios que desarrollaron el medicamento no recibirán derechos por sus ventas mientras la Covid-19 esté considerada como una emergencia de salud pública internacional por la Organización Mundial de la Salud (OMS).
Hace un par de días la Agencia de Medicamentos Europea (EMA) anunció que comenzó el proceso de revisión continua del medicamento antiviral oral molnupiravir, para el tratamiento de Covid-19 en adultos.
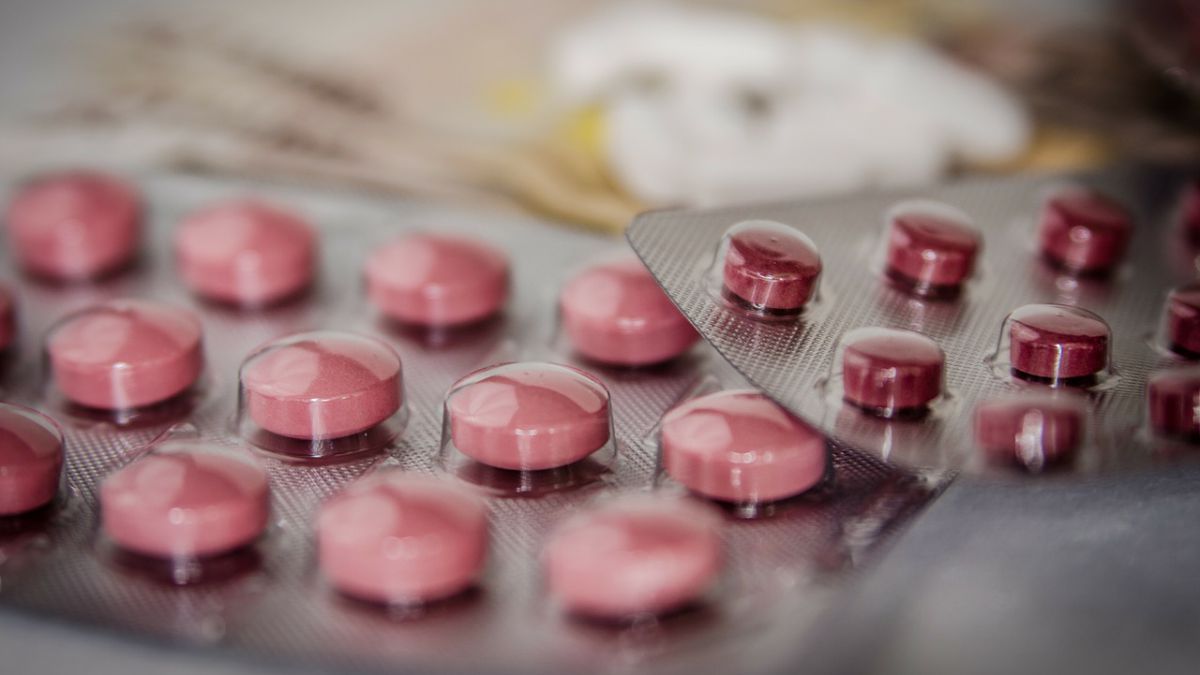
La decisión del comité de medicamentos humanos (CHMP) de la EMA de comenzar este proceso «se basa en los resultados preliminares de los estudios clínicos y de laboratorio (datos no clínicos)», informó el organismo mediante un comunicado.
Y continuó: «Estos estudios sugieren que el medicamento puede reducir la capacidad del SARS CoV-2 (el virus que causa Covid-19) para multiplicarse en el cuerpo, evitando -así- la hospitalización o la muerte en pacientes».
En septiembre el laboratorio anunció que lanzaba el ensayo clínico fase 3, MOVe-OUT, que se lleva a cabo simultáneamente en países como Argentina, Brasil, Chile, Colombia, Francia, Guatemala, Bulgaria, Alemania, Israel, Italia, Japón, Egipto, Filipinas, Polonia, Rusia, Canadá y Estados Unidos.
En Argentina, se realizará en 2 centros: Clínica Independencia (Vicente López, Provincia de Buenos Aires) y el Instituto Médico de la Fundación Estudios Clínicos (Rosario, Santa Fe).
El estudio MOVe-OUT evalúa el molnupiravir durante cinco días con una dosificación y forma de administración que se determinó en la fase previa de investigación del fármaco, finalizada en marzo de este año, y que, según sus desarrolladores, «evidenció la actividad antiviral del molnupiravir en pacientes que no fueron hospitalizados con Covid-19 que presentaban síntomas iniciales».

